多方合作发表JACS : 自由基SAM酶BlsE在杀稻瘟菌素S生物合成过程中催化自由基介导的1,2-二醇脱水反应
来源: 作者: 发布日期:2022-04-17 浏览次数:
自由基是具有不成对电子的活泼基团,其高度活泼的性质使得自由基反应的立体、位置选择性难以控制。但在自然界中,包括自由基SAM酶(Radical SAM enzymes)在内的多种酶却可以准确地控制自由基的产生与自由基中间体的反应,高效催化惰性键的活化以及复杂的化学转化。同时,由于参与了多辅因子、辅酶和多种重要活性天然产物的生物合成,近年来自由基SAM酶的研究越来越受到关注。
BlsE是杀稻瘟菌素S(BLS)生物合成基因簇中的blsE基因所编码的一个自由基SAM酶。早期研究中,BlsE被表征为SAM自由基脱羧酶,催化胞嘧啶葡萄糖醛酸(CGA)的5'-脱羧反应。然而,最终产物杀稻瘟菌素S结构中仍保有5'-羧基,倘若BlsE在杀稻瘟菌素S生物合成过程中行使的是脱羧功能,其结果似乎并不符合生物体内碳流代谢的经济性和高效性。近期,美国德克萨斯大学奥斯汀分校的刘鸿文教授课题组、中科院深圳先进技术研究院/中科院上海有机所周佳海研究员、厦门大学王斌举教授以及西北农林科技大学高锦明教授合作,对BlsE的体内功能进行了重新表征,发现该酶实际催化的是脱水反应,但因其产物具有不稳定的β-酮酸结构,而导致在体外反应中观测到的主要为非酶促脱羧后的产物。
在该研究中,作者发现BlsE的催化产物在反应液中较快地转变成CGA结构脱水和脱羧后的结构PPN,通过利用化学还原剂将BlsE产物中不稳定的酮基转换为羟基再加以结构分析,证明了BlsE的催化产物为带有5'-羧基的β-酮酸结构。作者进一步利用同位素标记的底物与氟代的底物替代物,并结合理论计算阐明了BlsE催化脱水反应的详细机制:(1)脱氧腺苷自由基攫取底物CGA中4'-C上的氢原子;(2)4'-羟基的质子转移至3'-羟基使其脱去;(3)产物自由基经由单电子还原淬灭。
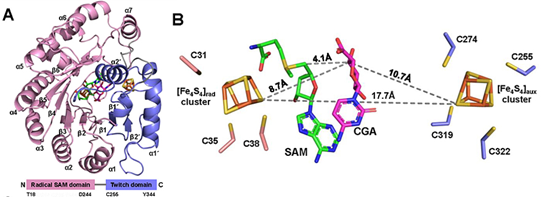
BlsE含有两个铁硫簇,属于Twitch酶家族,也是此酶家族中唯一已知的裂合酶。在该研究中,作者解析了BlsE的X-射线衍射晶体结构,以蛋白结构为指导,通过定点突变证实辅助的铁硫簇在催化的过程中是不可或缺的,更加凸显了BlsE与另外两个已知的单铁硫簇裂解酶DesII和AprD4的不同。作者进一步通过对BlsE-SAM二元复合物和BlsE-SAM-CGA三元复合物结构的研究以及分子动力学(MD)的模拟,深入揭示了BlsE催化反应的分子机制。
该工作发表于Journal of the American Chemical Society,2022,144, 4478–4486,DOI: 10.1021/jacs.1c12010,刘鸿文教授课题组的博士研究生李渝萱、西北农林科技大学/中科院上海有机所联合培养博士生候雪丽、刘鸿文教授课题组访问学者/中国医学科学院药物研究所的陈日道博士为该文的共同第一作者。刘鸿文教授、中科院深圳先进技术研究院/中科院上海有机所周佳海研究员、厦门大学王斌举教授与西北农林科技大学高锦明教授为该文的共同通讯作者。